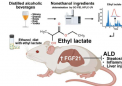
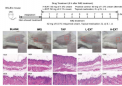
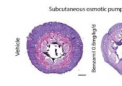
价电子排布式是描述原子或离子中参与化学键合的电子分布情况的重要工具。它在化学领域具有举足轻重的地位,不仅帮助我们理解元素的化学性质,还为预测化合物的形成提供了理论依据。
每个元素的价电子排布由其电子构型决定。例如,氧原子的电子排布为1s²2s²2p⁴,在其最外层(即价层)有6个电子。这些价电子决定了氧的化学行为,使其倾向于获得两个电子来达到稳定的八隅体结构,从而形成常见的氧化物或过氧化物。
过渡金属由于拥有部分填充的d轨道,其价电子排布更为复杂。比如铁(Fe)的基态电子排布为[Ar]3d⁶4s²,但在失去电子形成离子时,通常优先失去4s轨道上的电子,因此Fe²⁺的价电子排布为[Ar]3d⁶。这种特性使得过渡金属表现出多样化的氧化态和复杂的化学反应性。
价电子排布对于理解分子几何形状也至关重要。根据价层电子对互斥理论(VSEPR),分子中的价电子对会尽量远离彼此以减少排斥力,这直接影响了分子的空间排列方式。例如,水(H₂O)分子中氧原子有两对孤对电子和两对成键电子,导致其呈弯曲形。
此外,在有机化学中,碳原子的sp³、sp²和sp杂化状态直接反映了其价电子重新分配的结果,进而影响了整个分子的稳定性与反应活性。
总之,价电子排布式不仅是连接微观世界与宏观现象的桥梁,也是现代化学研究不可或缺的基础知识之一。通过对价电子的理解,科学家们能够更好地设计新材料、开发新药物,并探索未知领域的奥秘。
 新传媒网
新传媒网